La ranas más diminutas registradas hasta ahora fueron descubiertas en Nueva Guinea, la isla situada al norte de Australia.
Cuatro ejemplares de Paedophryne dekot (A yB) y P. verrucosa (C y D), que miden cerca de 8 mms. Foto: Fred Kraus
Fred Kraus, del Museo Bishop, en Hawaii, Estados Unidos, encontró los anfibios que miden apenas entre ocho y nueve milímetros de largo.
Contenido relacionado
Riesgo de extinción de anfibios, "más grave de lo previsto"
Posible control biológico del hongo que diezma a los anfibios
Se buscan "príncipes" para ranas en peligro
Las ranas pertenecen al genero Paedophryne, que sólo incluye anfibios diminutos y las dos nuevas especies fueron denominadas Paedophryne dekot y Paedophryne verrucosa.
El género Paedophryne había sido descubierto por Kraus en 2002 en la misma isla, pero no fue formalmente descrito sino hasta 2010.
Las especies catalogadas anteriormente eran de mayor tamaño, con una longitud de entre 10 y 11 milímetros.
"Fue muy difícil encontrar estas ranas porque dejan de emitir sonidos apenas uno se acerca", dijo Kraus a BBC Mundo.
"En mi expedición más reciente el mes pasado descubrí que es más fácil hallarlas de noche entre las hojas del bosque, pero aún así es difícil verlas por su tamaño diminuto".
Adaptación
"La miniaturización ocurre en muchos géneros de ranas en el mundo, pero es particularmente importante en Nueva Guinea, donde hay siete géneros que presentan esas características", dijo Kraus, cuyo estudio fue publicado en la revista Zookeys.
Esta rana diminuta de Borneo, Microhyla nepenthicola, fue descubierta en 2010 y mide unos 10 mms. Foto: © Indraneil Das/Instituto de Biodiversidad y Conservación Ambiental
Muchos géneros de anfibios tienen algunas especies pequeñas junto a otras de mayor tamaño, pero el género Paedophryne es único porque todas sus especies son diminutas.
Todos los miembros de este género tienen dígitos reducidos que no les permiten escalar superficies, por lo que estas ranas viven entre las hojas en descomposición en el suelo de los bosques.
Sus dígitos reducidos podrían ser el corolario de la menor dimension corporal requerida para vivir en un medio de hojas y musgo.
Es común que las ranas "en miniatura" vivan en estos hábitats. "Es probable que hayan evolucionado para consumir artrópodos muy pequeños entre las hojas en descomposición. Esto es ventajoso ya que pueden aprovechar fuentes de alimento que no utilizan otras ranas", dijo Kraus a BBC Mundo.
En peligro de extinción
Otra rana diminuta fue descubierta el año pasado en Borneo por Indraneil Das y Alexander Haas del Instituto de Biodiversidad y Conservación Ambiental de la Universidad Sarawak en Malasia y el Museo de Zoología de Hamburgo.
Una de cada tres especies de anfibios está en peligro de extinción. Foto: Angle Fitor/SPL
La minirana de Borneo, Microhyla nepenthicola, fue encontrada a orillas de un camino en el Parque Nacional Kubah y su nombre se debe al de la planta de la que depende para sobrevivir, Nepenthes ampullaria, que crece en la sombra de bosques densos. Las ranas depositan sus huevos dentro de la misma y los renacuajos crecen en el líquido que la planta acumula en su interior.
Los machos de esta rana de Borneo miden entre 10,6 y 12,8 mms, el tamaño de una arveja. Por ser tan diminutas, encontrarlas fue todo un desafío. Los investigadores las localizaron por sus llamados y luego las hicieron saltar sobre una tela blanca para examinarlas con más claridad.
Los anfibios son el grupo animal más amenazado del planeta: aproximadamente la mitad de las más de 6.500 especies conocidas están declinando y una de cada tres está en peligro de extinción. Los anfibios son muy sensibles a su entorno y el estudio de las ranas diminutas podría ayudar a entender el impacto de las variaciones ambientales en estos vertebrados.
Un estudio publicado este año por Christian Hof, del Centro de Investigaciones sobre Biodiversidad y Clima, en Frankfurt, Alemania, evaluó cuáles son las regiones que serán más afectadas en el futuro por tres amenazas principales: el cambio climático, la pérdida de hábitat y la enfermedad causada por un hongo que está devastando poblaciones de anfibios en diversos puntos del planeta.
Considerando el impacto y la intensidad de esas tres amenazas al mismo tiempo, los investigadores encontraron que el declive podría ser más rápido de lo previsto, especialmente en los trópicos. Para Hof, "en América Latina hay varias regiones de alta diversidad de anfibios, como América Central, el norte de Sudamérica y la Amazonia. Estas regiones son las que enfrentarán amenazas de gran intensidad en el futuro".
14 de diciembre de 2011
Encuentran las ranas más pequeñas del mundo
23 de noviembre de 2011
Expertos aseguran extinción de la jutiíta de la tierra
Tal afirmación tiene como base la inexistencia de huellas, entiéndanse pisadas y la ausencia de heces fecales. En su desaparición incidieron, a criterio del profesor Vicente Berovides Alvarez, especialista en conservación de la Empresa Nacional de Flora y Fauna, varias causas, entre ellas los incendios forestales, particularmente, en las plantaciones donde se refugiaba, la caza y la expansión de las ratas.
Ese animal, capromys sanfelipensis, catalogado de valioso endémico local, vivió hace años en el enclave, pero los depredadores naturales y el hombre prácticamente aniquilaron la otrora abundante población del roedor de solo 30 centímetros de talla y tenue coloración carmelita que anida dentro de la tierra. La jutiíta de tierra se alimentaba de mangle, pero como este posee poca proteína, de noche, salía en busca de residuos de pescado y moluscos.
Según el especialista pudieran existir en otros cayos al norte de Pinar del Río, con praderas de hierbas de vidrio, pero no cuentan con igual ecosistema y, además, su extinción se estima a finales de la década de los 90.
Precisó que para declarar una especie en extinción deben esperarse unos 50 años y que no conste registro alguno en la naturaleza, pero para esta no hay esperanzas.
En la decadencia de algunas especies influye también la situación económica, porque algunos recursos materiales y financieros se destinan a otras necesidades de primer orden del desarrollo y de la propia población y por ello es importante lograr un equilibrio para con medidas mínimas y no caras, proteger estos animales.
Su conservación es extremadamente difícil, pues la crítica disminución de la especie limitó que se procrearan de manera natural.
En cuevas y árboles de esta provincia habitan otras dos especies de jutías exclusivas de Cuba, denominadas Congo y Carabalí, que alcanzan más de 50 centímetros y hasta cinco libras de peso, en tanto han corrido mejor suerte que la diminuta, aunque son muy cotizadas por su sabrosa carne.
Con la apertura de una microestación biológica en los Cayos de San Felipe, se intensifican los programas científicos conservacionistas, entre ellos los dirigidos al cuidado de las tortugas marinas y otros reptiles, el manatí, aves, invertebrados y especies de la flora como manglares, manigua costera y vegetación de playa arenosa.
22 de noviembre de 2011
El agujero en la capa de ozono alcanza su tamaño máximo anual
La reducción de esta zona de la estratosfera en el hemisferio Sur alcanzó los 16 millones de kilómetros cuadrados el 12 de septiembre
El agujero en la capa de ozono en el hemisferio Sur llegó a su máximo anual el pasado 12 septiembre, al alcanzar los 16 millones de kilómetros cuadrados. El noveno mayor de los últimos 20 años, informó hoy laAdministración Atmosférica y Oceánica (NOAA) y la Agencia Espacial Norteamericana (NASA).
La capa de ozono protege la vida terrestre al bloquear los rayos ultravioleta del sol y su reducción adquiere especial importancia en esta época del año, cuando es verano en el hemisferio sur.
La NASA y la NOAA utilizan instrumentos de medición atmosférica aérea a bordo de globos y satélites para vigilar el agujero de ozono en el Polo Sur, los niveles globales de la capa de ozono en la estratosfera y las sustancias químicas artificiales que contribuyen a la disminución del ozono.
«Las temperaturas más frías que la media en la estratosfera causaron este año un agujero de ozono más grande que el promedio», dijo Paul Newman, jefe científico del Centro Goddard de Vuelos Espaciales de la NASA.
«A pesar de que era relativamente grande, el área del agujero de ozono este año año estaba dentro del rango que esperábamos, dado que los niveles químicos de origen humano persisten en la atmósfera», lamentó.
El director de la división de Observación Mundial de la NOAA, James Butler, señaló que el consumo de estas sustancias que destruyen el ozono disminuye poco a poco debido a la acción internacional, pero todavía hay grandes cantidades de estos productos químicos haciendo daño.
Sin embargo, la mayoría de los productos químicos permanecen en la atmósfera durante décadas.
NOAA ha estado siguiendo el agotamiento del ozono en todo el mundo, incluyendo el Polo Sur, desde varias perspectivas, utilizando globos atmosféricos durante 24 años para recoger los perfilesdetallados de los niveles de ozono, así como con instrumentos terrestres y desde el espacio.
Declaran extinto al Rinoceronte Negro de África Occidental
Se suma a la desaparición en Vietnam de la subespecie de Java. Y es posible que tampoco exista ya ningún ejemplar de Rinoceronte Blanco de África Central, según la UICN
El Rinoceronte Negro de África Occidental (Diceros bicornis longipes) ha sido declarado oficialmente extinto por la Unión Internacional para la Conservación de la Naturaleza (UICN), informa AP. Otras dos subespecies de rinoceronte están próximas a correr la misma suerte, apunta la organización. Hablamos del Rinoceronte Blanco de África Central (Ceratotherium simum cottoni) y del Rinoceronte de Java (Rhinoceros sondaicus), cuya desaparición en Vietnam ya ha sido confirmada por la ONGWWF, después de que unos cazadores furtivos acabaran con el último ejemplar en el país asiático en 2010.
La cuarta parte de las especies de mamíferos presentes en el Planeta están en peligro, afirma la UICN. Alrededor de un tercio de las 61.900 especies catalogadas por el organismo aparecen clasificadas como «vulnerable», «amenazada», «críticamente amenazada» o «extinta» en su Lista Roja. En el caso de los anfibios y los reptiles, por su parte, su declive se está produciendo más rápidamente si cabe.
La subespecie de Rinoceronte Blanco del Sur de África (Ceratotherium simum simum), por el contrario, está recuperándose paulatinamente: su número ha pasado de 100 a finales del siglo XIX a los 20.000 individuos que se contabilizan en la actualidad. El Caballo salvaje o de Przewalski (Equus ferus przewalskii), originario de Asia Central, también se ha movido del estatus de «crítico» al de «amenazado».
En Madagascar, uno de los grandes reservorios de biodiversidad de la Tierra, el 40% de los reptiles se encuentran amenazados. Y el ciprés chino (Glyptostrobus pensilis), debido a la deforestación, ha experimentado una considerable regresión en los últimos años.
La nueva lista de UICN recoge las incorporaciones recientes, entre ellas 26 anfibios: los dos sapos venenosos bautizados Ranitomeya benedicta y Ranitomeya summersi son dos buenos ejemplos. Ambas variedades se encuentran amenazadas debido al tráfico ilegal de animales de compañía y la pérdida de su hábitat.
Predicen una disminución global de especies de anfibios
Las poblaciones de anfibios están disminuyendo en todo el mundo: más del 30% de todas las especies aparecen clasificadas como amenazadas en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza(UICN).
Según apunta la institución, existen «múltiples factores» que ponen en riesgo la diversidad global de los anfibios, pero su distribución e interacciones son aún poco conocidas. Un nuevo estudio, cuyo autor principal es el doctor Christian Hof, de la Universidad de Copenhague (Dinamarca), indica que, «preocupantemente», las áreas de mayor riqueza de grupos taxonómicos de anfibios son las que se encuentran sujetas a una mayor alarma.
La investigación, publicada en la revista Nature, fue dirigida de forma conjunta por los profesores Carsten Rahbek, del Centro de Macroecología, Evolución y Clima de la Universidad de Copenhague, y Miguel B. Araújo, delConsejo Superior de Investigaciones Científicas (CSIC) en el Museo Nacional de Ciencias Naturales de Madrid. Asimismo, fue realizada en colaboración con un colega de ambos de la Universidad de Yale (Estados Unidos), Walter Jetz.
Superposición de amenazas
El cambio climático, el cambio de uso del suelo y la enfermedad fúngica quitridiomicosis son las contingencias más serias que «acechan» a los anfibios. Hof y su equipo evaluaron cómo se distribuían estas estas amenazas en relación con la repartición global de los anfibios.
«Las regiones donde el clima y el cambio de uso del suelo tienen un mayor impacto sobre los anfibios tienden a superponerse. Por el contrario, el riesgo de la enfermedad fúngica muestra poca superposición espacial con respecto a las otras dos», señala el investigador.
Otra de las conclusiones de los expertos: la mayoría de las zonas del Planeta que cuentan con una biodiversidad rica poseen más probabilidades de estar expuestas a una o más amenazas que aquellas áreas que albergan una baja cantidad de especies.
«Más de dos tercios de la diversidad global de anfibios se encuentran fuertemente afectados por, al menos, una de las tres amenazas consideradas», afirma Araújo.
Rahbek, por su parte, pronostica que la disminución de anfibios se acelerará en las próximas décadas. «Los resultados ponen de manifiesto la necesidad de una mayor esfuerzo conservacionista», concluye Jetz.
15 de noviembre de 2011
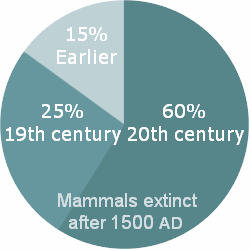
Lista de los mamíferos extintos después del año 1500
Click on the scientific names to go to the database entries for the species.
| Mammals Extinct after 1500 AD | ||
| # | Scientific name [IUCN database links] | Common name |
| 1 | Bettongia pusilla | Nullarbor Dwarf Bettong |
| 2 | Boromys offella | Oriente Cave Rat |
| 3 | Boromys torrei | Torre’s Cave Rat |
| 4 | Bos primigenius | Auroch |
| 5 | Brotomys voratus | Hispaniolan Edible Rat |
| 6 | Caloprymnus campestris | Desert Rat Kangaroo |
| 7 | Chaeropus ecaudatus | Pig-footed Bandicoot |
| 8 | Conilurus albipes | White-footed Rabbit-rat |
| 9 | Coryphomys buehleri | Buhler’s Coryphomys |
| 10 | Cryptonanus ignitus | Red-bellied Gracile Mouse Opossum |
| 11 | Cryptoprocta spelea | Giant Fossa |
| 12 | Cuscomys oblativa | — |
| 13 | Desmodus draculae | Giant Vampire Bat |
| 14 | Dusicyon australis | Falkland Island Wolf |
| 15 | Gazella bilkis | Queen Of Sheba’s Gazelle |
| 16 | Gazella saudiya | Saudi Gazelle |
| 17 | Geocapromys columbianus | Cuban Coney |
| 18 | Geocapromys thoracatus | Little Swan Island Hutia |
| 19 | Heteropsomys insulans | Insular Cave Rat |
| 20 | Hexolobodon phenax | Imposter Hutia |
| 21 | Hippopotamus lemerlei | Madagascan Dwarf Hippopotamus |
| 22 | Hippopotamus madagascariensis | Madagascan Pygmy Hippo |
| 23 | Hippotragus leucophaeus | Bluebuck |
| 24 | Hydrodamalis gigas | Steller’s Sea Cow |
| 25 | Isolobodon montanus | Montane Hutia |
| 26 | Isolobodon portoricensis | Puerto Rican Hutia |
| 27 | Juscelinomys candango | Candango Mouse |
| 28 | Lagorchestes asomatus | Central Hare Wallaby |
| 29 | Lagorchestes leporides | Eastern Hare Wallaby |
| 30 | Lagostomus crassus | — |
| 31 | Macropus greyi | Toolache Wallaby |
| 32 | Macrotis leucura | Lesser Bilby |
| 33 | Megalomys desmarestii | Desmarest’s Pilorie |
| 34 | Megalomys luciae | Santa Lucian Pilorie |
| 35 | Megaoryzomys curioi | Galapágos Giant Rat |
| 36 | Monachus tropicalis | Caribbean Monk Seal |
| 37 | Neotoma anthonyi | Anthony’s Woodrat |
| 38 | Neotoma bunkeri | Bunkers Woodrat |
| 39 | Neotoma martinensis | San Martin Island Woodrat |
| 40 | Neovison macrodon | Sea Mink |
| 41 | Nesophontes edithae | Puerto Rican Nesophontes |
| 42 | Nesophontes hypomicrus | Atalaye Nesophontes |
| 43 | Nesophontes major | — |
| 44 | Nesophontes micrus | Western Cuban Nesophontes |
| 45 | Nesophontes paramicrus | St. Michel Nesophontes |
| 46 | Nesophontes zamicrus | Haitian Nesophontes |
| 47 | Nesoryzomys darwini | Darwin’s Galapagos Mouse |
| 48 | Nesoryzomys indefessus | Indefatigable Galapagos Mouse |
| 49 | Noronhomys vespuccii | — |
| 50 | Notomys amplus | Short-tailed Hopping Mouse |
| 51 | Notomys longicaudatus | Long-tailed Hopping Mouse |
| 52 | Notomys macrotis | Big-eared Hopping Mouse |
| 53 | Notomys mordax | Darling Downs Hopping Mouse |
| 54 | Oligoryzomys victus | St. Vincent Pygmy Rice Rat |
| 55 | Onychogalea lunata | Crescent Nailtail Wallaby |
| 56 | Oryzomys antillarum | Jamaican Rice Rat |
| 57 | Oryzomys nelsoni | Tres Marias Island Rice Rat |
| 58 | Palaeopropithecus ingens | Large Sloth Lemur |
| 59 | Perameles eremiana | Desert Bandicoot |
| 60 | Peromyscus pembertoni | Pemberton’s Deer Mouse |
| 61 | Plagiodontia ipnaeum | Samana Hutia |
| 62 | Potorous platyops | Broad-faced Potoroo |
| 63 | Prolagus sardus | Sardinian Pika |
| 64 | Pseudomys glaucus | Blue-grey Mouse |
| 65 | Pseudomys gouldii | Gould’s Mouse |
| 66 | Pteropus brunneus | Percy Island Flying Fox |
| 67 | Pteropus pilosus | Large Palau Flying Fox |
| 68 | Pteropus subniger | Lesser Mascarene Flying-fox |
| 69 | Pteropus tokudae | Guam Flying Fox |
| 70 | Rattus macleari | Maclear’s Rat |
| 71 | Rattus nativitatis | Bulldog Rat |
| 72 | Rucervus schomburgki | Schomburgk’s Deer |
| 73 | Solenodon marcanoi | Marcano’s Solenodon |
| 74 | Thylacinus cynocephalus | Thylacine (Tasmanian wolf) |
| 75 | Xenothrix mcgregori | Jamaican Monkey |
| 76 | Zalophus japonicus | Japanese Sea Lion |
| Mammal subspecies extinctions | ||
| 1 | Alcelaphus buselaphus ssp. buselaphus | Bubal Hartebeest |
| 2 | Equus quagga ssp. quagga | Quagga |
| 3 | Kobus leche ssp. robertsi | Roberts’ Lechwe |
| 4 | Ourebia ourebi ssp. kenyae | Kenya Oribi |
| 5 | Panthera tigris ssp. balica | Bali Tiger |
| 6 | Panthera tigris ssp. sondaica | Javan Tiger |
| 7 | Panthera tigris ssp. virgata | Caspian Tiger |
| Extinct in the Wild | ||
| 1 | Elaphurus davidianus | Père David’s Deer |
| 2 | Oryx dammah | Scimitar-horned Oryx |
Regional subespecie extinta:
| Scientific name | Species name | Region | Name of extinct variant |
| Panthera leo | African lion | Morocco | Barbary lion |
| South Africa | Cape lion | ||
| Ursus arctos | Brown bear | Morocco | Atlas bear |
| Mexico | Mexican grizzly bear |
El gráfico de la derecha es una guía aproximada. Hay muchas especies en la lista sin avistamientos registrados desde que se describió por primera vez. Otros sólo se conocen a partir de restos óseos y no han sido vistos con vida. Por ejemplo, la entrada de la base de datos para Hippopotamus lemerlei dice: "Madagascar hipopótamos pueden haber sobrevivido hasta tiempos recientes ... en particular sobre la base de la tradición oral local ..."primera especie descrita en el siglo 19 y nunca he visto una vez más se han dividido entre los días 19 y siglo 20 en el gráfico circular.